今年的诺贝尔化学奖史无前例首次同时颁发给两位女科学家——马克斯·普朗克感染生物学研究所主任伊曼纽尔·夏彭蒂耶(Emmanuelle Charpentier)和加州大学伯克利分校的生物化学家詹尼佛·A.杜德娜(Jennifer A. Doudna)。她们因在基因编辑研究领域做出的卓越贡献而获奖。

10月7日,2020年诺贝尔化学奖揭晓,法国科学家伊曼纽尔·夏彭蒂耶(Emmanuelle Charpentier)和美国科学家詹尼佛·A.杜德娜(Jennifer A. Doudna)获得了这一奖项。
据介绍,夏彭蒂耶和杜德娜利用CRISPR-Cas9“基因剪刀”,以极高的精度编辑了动物、植物和微生物的DNA。来自诺奖官网的消息显示,这项技术对生命科学产生了革命性的影响,可以帮助研究者开发新的癌症疗法,并使治愈遗传疾病的梦想成为现实。
到底什么是基因编辑?基因编辑之于我们有何种意义?我们应该如何看待基因编辑?它拥有着怎样的过去和未来?基因编辑研究的背后又有哪些惊心动魄的故事?在詹尼佛·A.杜德娜和塞缪尔·H.斯坦伯格所著的《破天机:基因编辑的惊人力量》一书中,我们或许可以得到这些问题的答案。这本即将于11月出版中文版的著作中,身为CRISPR技术先驱的杜德娜与亲历者斯坦伯格,回顾了基因编辑技术的发展史,展望了未来的发展趋势,并梳理了相关社会与伦理议题。
以下内容经湖南科学技术出版社·原力授权节选自《破天机:基因编辑的惊人力量》,较原文有删节修改,标题为编者所加,非原文所有。

《破天机:基因编辑的惊人力量》,[美]詹尼佛·A.杜德娜、[美]赛缪尔·H.斯坦伯格著,湖南科学技术出版社·原力,2020年11月。
作者丨[美]詹尼佛·A.杜德娜 赛缪尔·H.斯坦伯格
摘编丨安也
2009年,第一代基因编辑技术出现了,它依靠的是从黄单胞杆菌里发现的一种新型蛋白质,叫作类转录活化因子(TALEs)。这些蛋白质与锌指核酸酶的构造非常类似:它们都是由多个重复片段组成,每个片段识别特定的DNA序列。区别在于:每个锌指核酸酶的手指识别三个DNA碱基,而每个类转录活化因子的片段可以识别单个DNA碱基。这使得科学家很容易推断出哪个片段识别哪个DNA碱基,于是他们可以重新编辑,使其识别更长的DNA序列。在锌指核酸酶中,这项工作听起来简单,实际上困难;但在类转录活化因子中,它的确很简单。
研究人员转而探索这种新技术。类转录活化因子的编码序列一经破解,三个实验室就把类转录活化因子与锌指核酸酶的剪切模块融合,创造出了类转录活化因子核酸酶(简称TALENs)。类转录活化因子核酸酶在细胞内引发基因编辑的效果非常惊人,科学家对它做了某些设计上的改进,更方便了它们的构建和使用。
就在人们发现类转录活化因子核酸酶并用于基因编辑不久,最新的(也许是终极的)基因编辑技术出现了。这项技术叫作CRISPR⸺正是在这里,我的故事跟基因编辑的故事衔接了起来。基因编辑技术经历了漫长的发展历史,但它马上要进入一个激动人心的新时代。
我们应该如何看待基因编辑?
科学家可以使用强大的生物技术来修饰活细胞里的DNA,甚至改造这个星球上所有物种的遗传密码。在诸多基因编辑的工具中,最新,也可能是最有效的,当属CRISPR-Cas9(简称为CRISPR)。有了CRISPR,生物体的基因组就变得像文本一样可以被编辑。
只要科学家知道了某个性状的基因,我们就可以利用CRISPR在它的基因组中插入、编辑或删除该基因。这比目前其他任何基因操作技术都更简单有效。
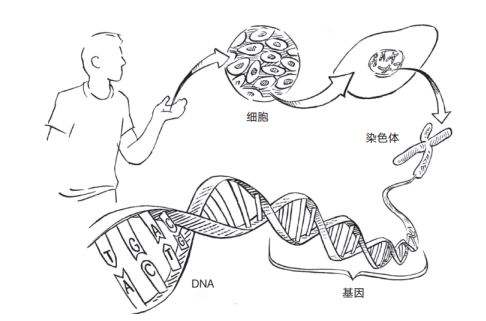
DNA——生命的语言。
科学家利用CRISPR制造出了一种“基因增强版”的小猎犬,它肌肉发达,像是犬类里的施瓦辛格,而科学家改变的只是参与控制肌肉形成的基因的一个碱基对。在另一个例子里,通过抑制猪的身体里对生长激素起反应的基因,研究人员制造出了迷你猪,它大小接近家猫,可以作为宠物出售。科学家也在陕北山羊身上进行了类似的实验,使用CRISPR编辑了它的基因组,同时提高了肌肉含量(这意味着更多的肉)与含毛量(这意味着更多的山羊绒)。通过CRISPR,遗传学家已经把亚洲象改造得越来越象猛犸象,或许有朝一日会复原这种已经灭绝的动物。
与此同时,在植物界,CRISPR也已经被广泛用于改造农作物的基因组。这为农业革命铺好了道路,将进一步显著提高人们的饮食质量,确保世界粮食安全。通过基因编辑,科学家已经制造出了抗病水稻、晚熟番茄、脂肪酸水平更健康的大豆,以及含有更少神经毒素的土豆。在实现这些目标的时候,食品学家并没有依赖杂交技术,而只是稍微调整了植物基因组的少数几个碱基对。
在实验室培养的人类细胞里,这种新的基因编辑技术已经纠正了许多遗传病,包括囊状纤维化、镰状细胞病、某些形式的眼盲、重症复合免疫缺陷等。利用CRISPR,科学家可以从人类DNA的32亿个碱基对中发现,继而更正单个基因突变——这已经很令人惊叹了,但是它还可以完成更复杂的修饰。研究人员已经纠正了杜兴氏肌肉萎缩症患者身上的突变基因,从而治愈了疾病。在一个血友病的案例中,研究人员利用CRISPR对患者身上发生颠倒的50多万个DNA碱基对进行了精确调整。CRISPR也可以用于治疗艾滋,比如,从患者受感染的细胞中切除病毒的DNA,或者编辑患者的DNA,避免更多细胞受到感染。
基因编辑在临床应用上的可能远不止于此。由于CRISPR允许我们精准、直接地进行基因编辑,每一种遗传病——只要我们知道它的突变基因——理论上都可以得到治疗。事实上,医生已经开始使用改造的免疫细胞治疗癌症,这些免疫细胞携带着增强版的基因,可以更好地消灭癌细胞。虽然CRISPR离大规模临床应用还有一段路要走,但它的潜力毋庸置疑:基因编辑有望提供新的治疗方案,甚至挽救生命。
CRISPR技术的影响不止于此,除了治疗疾病,它也可以预防疾病。它简单有效,甚至可以用来修饰人类的生殖细胞系(germline),从而影响后代的遗传信息。不必怀疑,这项技术有朝一日会被用于改造人类的基因组,长久地改变人类的遗传物质,虽然我们目前还不知道这一天何时到来。
一开始,我认为要把这些讨论留给受过专业生物伦理学训练的人,自己继续投身于火热的生物化学研究。但与此同时,作为这个领域的开拓者之一,我感到有责任参与讨论这个话题:这些技术可能如何被使用,应当如何被使用。尤其是,我希望更多的人参与这个讨论,不仅仅是科研人员和生物伦理学者,也包括其他利益相关群体,包括社会科学家、决策者、宗教领袖、管理人员,以及普罗大众。鉴于这项科技进展会影响到全人类,我们有必要让社会各界人士都参与进来。更重要的是,我感到了开始这种对话的紧迫性,如果等这些技术已经开始应用了再试图加以约束,恐怕为时已晚。
基因编辑迫使我们直面这个棘手的问题:改造人类遗传物质的界限何在?有人认为,一切形式的遗传改造都是邪恶的,违背了神圣的自然规律,伤害了生命的尊严;另一些人认为,基因组只是“软件”——我们当然可以修改、清理、更新、升级它们,他们更进一步争辩道,让人类受制于有缺陷的遗传信息不仅有违理性,也有悖道德。基于这些考虑,我们倡议禁止在人类胚胎中进行基因编辑,而其他人则提议科学家放下顾虑,勇往直前。
我们不能忽视了基因编辑给我们——特别是对遗传病患者——提供的无比珍贵的医疗机遇。试想,假如有人知道了他/她携带着一份突变版本的HTT基因(这意味着他/她肯定会患上早发性失智症),如果他/她能够提前获得基于CRISPR的治疗,在症状发作之前就剔除突变的DNA,这会免去多少痛苦——而这种治疗手段在以前是无法想象的。因此,虽然我们还在辩论是否应当对生殖细胞进行基因编辑,但我们也很小心地避免让公众对CRISPR产生敌意,甚至反对基因编辑技术的临床应用。
Cas9的功能究竟是什么?
Csn1蛋白质的名字几经演变,最终,在2011年夏天,确定为Cas9。在我追踪Cas9相关研究的时候,虽然它变来变去的名字带来了一些麻烦,但是我从未怀疑过它的重要性。罗多尔·巴兰高和菲利普·霍瓦特在2007年的研究表明,如果使cas9基因失活,嗜热链球菌抵抗病毒入侵的能力会下降。此外,约西亚娜·加诺和席尔万·莫伊诺发现噬菌体基因组在CRISPR免疫反应过程中被切开之后,又进一步表明,如果使cas9基因失活,CRISPR就不会摧毁病毒的DNA。
与之类似,在埃马纽埃尔(埃马纽埃尔·卡彭蒂耶,Emmanuelle Charpentier)使用化脓链球菌的实验中,cas9基因失活会导致CRISPR转录出的RNA分子残缺,并降低整体的免疫水平。最终,在2011年秋季,由维尔日尼胡斯·塞尼相克斯实验室和丹尼斯克公司的罗多尔·巴兰高、菲利普·霍瓦特共同完成的研究显示,cas9基因是嗜热链球菌中对于抗病毒反应的一个必需的cas基因。
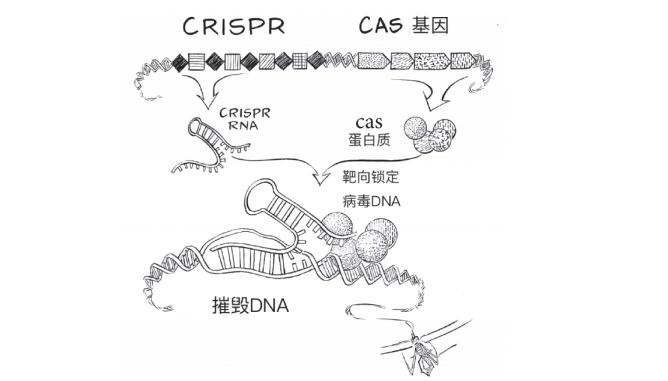
CRISPR的RNA分子与Cas蛋白质靶向锁定病毒DNA。
随着我对Cas9的了解越来越多,我也越来越意识到Cas9在II类CRISPR免疫反应的DNA摧毁阶段可能扮演了关键角色。起码,在链球菌属里,它是一个必需基因,但是我们有理由认为,II类系统中的每一个关键成分在其他系统里都同样重要。不过,Cas9的功能究竟是什么,我们仍然不清楚。
马丁(捷克博士后科学家马丁·耶奈克,Martin Jinek)、我和埃马纽埃尔,进行了一次Skype网络电话会议,开始商议Cas9实验要采取的策略。安排这次会议颇费周章:埃马纽埃尔当时在瑞典北部的于奥默大学(Umeå University),比美国太平洋时间早了10个小时,而她实验室里领衔CRISPR课题的是克日什托夫·切林斯基(Krzysztof Chylinski),在维也纳大学工作,这是埃马纽埃尔先前的工作机构。总之,这是一个相当国际化的合作团队:一位人在瑞典的法国教授,一个在奥地利的波兰学生,一个德国学生,一个捷克博士后,以及一位在伯克利的美国教授。
我们终于找到了一个适合所有人的时间,然后就开始规划实验蓝图。从我们实验室的角度看,最初的目标相当直接:我们需要想办法分析、纯化Cas9蛋白质,这是埃马纽埃尔的实验室无法做到的。有了Cas9在手,我们就可以着手进行生化试验,鉴定Cas9是否如我们推测的那样与CRISPR的RNA分子相互作用,以及它在抗病毒免疫反应中发挥了什么功能。
埃马纽埃尔的博士学生克日什托夫给我们寄来了一个质粒,其中包含了化脓链球菌的cas9基因,然后迈克在马丁的细心帮助下开始蛋白质纯化的工作。首先,迈克把重组的DNA引入了不同类型的大肠杆菌,他系统地测试了几十种不同的条件,来优化Cas9蛋白质表达,这就像园丁筛选不同的土壤和肥料组合,以找出适合新花卉的最优生长条件。其次,迈克测试了纯化出的Cas9蛋白质的稳定性。
有些蛋白质非常娇贵,使用一次之后就“变质”了,往往是因为蛋白质凝聚或者沉淀,会导致试管中的蛋白质溶液变成奶白色;另外一些蛋白质则可以反复冻融,状态依然稳定。我们很幸运⸺Cas9蛋白质很稳定。最后,进行生化实验的时间终于到了。在迈克和马丁纯化、分离Cas9蛋白质的过程中,我们就猜想,这个蛋白质如果具有切割DNA的功能,这可能要依赖于向导RNA。在我们研究过的I类CRISPR系统中,向导RNA与多个Cas蛋白质结合,形成识别和切割DNA的分子复合体。我们设想,Cas9的工作方式可能与此类似。事实上,氨基酸序列分析表明,Cas9蛋白质里可能有两个独立的核酸切割模块,其中至少有一个会切割噬菌体的DNA。
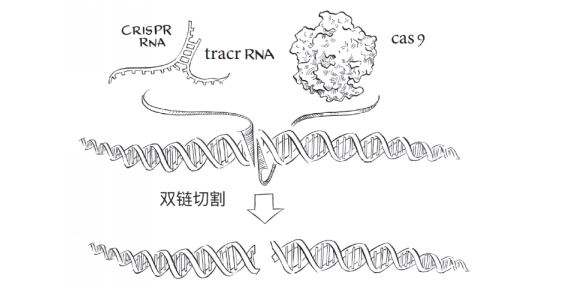
Cas9使用两个RNA分子切割DNA。
迈克在我们实验室的工作马上就要结束了⸺他马上要返回德国,完成博士论文,而且已经订好了机票,但是,迈克和马丁下决心测试纯化的Cas9酶是否可以切割DNA。他们参照埃马纽埃尔在化脓链球菌中的工作,合成出了CRISPR的RNA分子。然后,他们把这些RNA分子与Cas9蛋白质和一些DNA样品混合起来。重要的是,这些DNA样品中有一段序列跟这些RNA配对。
像大多数科学探索一样,这次实验以失败告终。在接触Cas9蛋白质和配对的向导RNA前后,DNA没有任何变化。要么迈克的实验设计不合适,要么Cas9的确没有切割DNA的功能。迈克在实验室组会展示了他的结果,悻悻地返回德国了。这个夏天辛勤的分离、纯化、研究Cas9的工作似乎是竹篮打水一场空。
在我们跟埃马纽埃尔、克日什托夫的合作进展过程中,马丁开始跟迈克密切合作,并指导他的实验,但马丁也开始寻找教职。面试的时候,他的足迹也遍及世界各地,包括瑞士,他最终接受了苏黎世大学的工作邀请。不过,对我们来说,幸运的是,在迈克离开的时候,马丁的日程安排稍微不那么紧张了,因此他可以从迈克遗留的问题入手,接手这个课题。他把注意力转向了Cas9,打算解决这个遗留问题:Cas9的功能到底是什么?
迈克和马丁的工作似乎表明了Cas9不能切割DNA,但是,实验本身是否可能有问题呢?这有许多可能,从最无趣的(比如,试管里的蛋白质降解了)到有趣的(比如,我们缺少了该反应必需的一个成分)。为了探索后一种可能,马丁和克日什托夫开始尝试不同的办法来设计检测DNA切割的实验。真是无巧不成书,他们很快发现,他俩长大的地方非常接近⸺克日什托夫在波兰境内,而马丁在当时的捷克斯洛伐克境内,他们都说波兰语,这极大地方便了他们通过Skype交流,商讨实验。
最终,克日什托夫和马丁进行的实验表明,除了向导RNA,他们还需要第二种RNA,叫作tracrRNA,埃马纽埃尔实验室发现,在化脓链球菌中,tracrRNA对于向导RNA合成是必需的。结果很简单,但我们却非常兴奋:与向导RNA分子里20个碱基完全匹配的DNA被干净地切开了。对照实验表明,这种匹配对于切割是必需的,如同Cas9蛋白质和tracrRNA同样是必需的。
本质上,这些结果以最少的成分模拟了CRISPR免疫反应在细胞内的进程⸺Cas9和两个RNA分子代表了细胞内的分子,而DNA分子代表了噬菌体的基因组。最重要的是,基因组里有20个DNA碱基与向导RNA分子配对,这意味着,向导RNA与DNA的一条链可以通过碱基配对形成双螺旋。这样的DNA-RNA双螺旋可能是Cas9特异性切割DNA的关键之处。
我们无法直接看到DNA被切割,所以需要一种灵敏的检测方法监控试管内的DNA切割反应。一段含有50个碱基对的DNA双螺旋长约17纳米,大致相当于最细的头发丝直径的千分之一。即使是用最强大的显微镜也无法看到它,因此,马丁和克日什托夫采用了核酸研究人员最爱的两种工具:放射性同位素磷和凝胶电泳分析。放射性磷原子可以通过化学反应与DNA分子结合,使DNA在感光胶片上显影,由于DNA带有负电,它在电场中会向正极运动,凝胶中的空隙则起到了筛子的作用,使得DNA可以根据大小在凝胶电泳中得到区分。
如果DNA被Cas9蛋白质切开,那么我们就可以看到两条带,否则就只有一条带。马丁进一步表明,Cas9蛋白质在向导RNA与DNA匹配的位置把DNA的双链都切开了。重要的是,向导RNA和tracrRNA分子在切割完DNA之后并未发生变化,因此可以被Cas9重复使用。看到这些结果,我们意识到,我们澄清了这个DNA切割机器的几个关键环节,包括化脓链球菌和嗜热链球菌(以及其他含有类似CRISPR系统的细菌)中靶向识别噬菌体序列,进而摧毁噬菌体DNA的分子机制。DNA切割的三个关键成分是Cas9酶、向导RNA和tracrRNA。
Cas9酶究竟如何在RNA的指导下切割DNA?
这些结果令我倍感振奋,但与此同时,这也引出了一系列亟待解决的问题。为了理解Cas9酶究竟如何在RNA的指导下切割DNA,我们需要精确定位Cas9蛋白质中执行切割功能的区域。为了证明DNA切割的专一性,以及切割依赖于向导RNA与DNA序列的匹配,我们需要逐个碱基地改变DNA序列,并表明当RNA-DNA匹配不够完美的时候,切割就无法进行。要表明向导RNA和tracrRNA是如何工作的,我们需要对这两种分子进行系统的缺失突变,找出真正必需的RNA片段。
为了回答这些问题,马丁和克日什托夫进行了辛苦的工作,但很快,一个清晰的画面逐渐浮现出来。他们发现,Cas9蛋白质会锚定在DNA双螺旋上,撬开DNA双链,使CRISPR的RNA分子与DNA的一条链形成新的双螺旋,然后,Cas9蛋白质使用两个核酸切割模块把DNA的双链同时切开,制造出双链断裂。
事实上,Cas9可以锁定并切割任何与向导RNA配对的DNA序列。打个比方,向导RNA的功能就像GPS可以指导Cas9精确定位到目标区域,即向导RNA和DNA配对的位置。Cas9是一个真正可以操作的核酸酶,我们可以定制设计该RNA分子,使它靶向锁定任何DNA序列。有了包含20个碱基的向导RNA,Cas9可以找到任何与其配对的DNA,并进行切割。
考虑到细菌与病毒在演化过程中鏖战不休,Cas9的功能不难理解。配备了从CRISPR序列中转录出的RNA分子,Cas9可以在噬菌体基因组中轻易地找到与之对应的DNA区域。这是细菌的巡航导弹⸺针对病毒的DNA精确快速地实施打击。
有了马丁和克日什托夫的实验结果,我们就可以着手解决下一个问题了:如果细菌可以用Cas9蛋白质来切割特定的病毒DNA序列,那么,我们是否可以用Cas9切割其他DNA序列,而不局限于噬菌体?
马丁和我清楚基因编辑领域的进展以及它的潜力,我们也知道锌指核酸酶和TALEN的核酸酶的致命缺点。我们不无惊叹地意识到,我们已经误打误撞发现了一个新系统,它有望超越现有的基因编辑技术。要把这个微小的分子机器变成强大的基因编辑工具,我们还需要更进一步的实验。
目前为止,我们把一个复杂的免疫系统还原成了几个可以分离、修饰并重新组合起来的元件。此外,通过精细的生化试验,我们理解了这些元件的功能,并推断出了其分子机理。下一步,我们要做的是,确认可以改装Cas9和向导RNA分子来靶向锁定并切割任何DNA序列。这个实验会真正展示出CRISPR的全部威力。这一步⸺改造CRISPR-Cas9分子机器⸺事实上包括了两小步:产生一个想法,再用实验验证它。
首先是要有想法。马丁向来一丝不苟,为了鉴定每一个碱基对功能的影响,他系统地修饰了RNA分子⸺包括用于靶向锁定DNA的向导RNA分子,以及把它和Cas9结合在一起的tracrRNA分子。有了这些知识,马丁和我进行头脑风暴,考虑如何把这两种分子组合到一起。如果我们可以把一个分子的尾巴跟另一个的头部融合起来,制造出杂合的RNA,如果可行,那会大大简化该分子机器,两条RNA分子⸺向导分子(CRISPRRNA)和协助分子(tracrRNA)⸺将合二为一。显然,如果CRISPR要用于基因编辑,简化的系统用途会更广。
基于这个想法,我们设计了实验。我们需要测试这个融合的RNA分子,并鉴定它是否依然可以指导Cas9切割对应的DNA序列。此外,我们的实验还可以回答Cas9蛋白质是否真的可以切割任何DNA序列,而不只是针对噬菌体的基因片段。这时,我们意识到了这是一个重大突破,为了尽快完成实验,我们并不想浪费时间寻找那些实验室没有的基因。
于是,出于方便,而不是偏好,我们决定使用一个来自水母的编码绿色荧光蛋白质的基因,即GFP(GFP广泛应用于世界各地的实验室,用于示踪细胞及其蛋白质成分)。马丁在GFP基因里选取了长度为20个碱基的5段区域,并针对性地设计了5种配对的RNA分子。准备好了新的单链RNA分子之后,我们就把它们与Cas9蛋白质以及GFP基因放在同样的DNA切割反应⸺现在,这个酶促反应已经成了常规实验。

CRISPR-Cas9催化的DNA切割是可以调控的。
然后,我们静静地等待着结果。当我们站在实验室的电脑前,马丁跟我细细讲解GFP实验数据的时候,我看到了一张漂亮的凝胶扫描图。果然,所有的GFP基因都在预期的位点被切开了。每一条单链RNA分子都像预期的那样工作了,在水母的GFP基因里锁定了预期的靶点,与Cas9合作完成了精确切割。
改写生命密码:新技术可以用来编辑任何基因组
我们做到了!在很短的时间里,我们构建并验证了一项新技术。在锌指核酸酶和TALEN蛋白的研究基础上,这项新技术可以用来编辑基因组⸺任何基因组,而不仅仅是噬菌体。利用细菌的第五种防御系统,我们找到了改写生命密码的办法。
那天晚上,我在厨房里做饭的时候,脑海中仍然闪现着这些微小分子的图像,它们在翩翩起舞:Cas9和向导RNA在细菌体内盘旋,寻找配对的DNA碱基。忽然,我情不自禁地笑出声来。细菌用这种方式来寻找并摧毁噬菌体,何其精妙!而我们能把这个如此根本的生物学过程改造并用于完全不同的目的,又是何其不可思议!这是一段纯粹的欢乐时光,一段愉快的发现之旅⸺这种感觉,正像是多年之前我在赫姆斯实验室的感受。
2012年6月,埃马纽埃尔和克日什托夫来伯克利参加一个学术研讨会,这让马丁和我有机会跟他们再次团聚。说来难以置信,虽然我们的合作进展如此之快,我们的交流基本上都在虚拟世界。经过无数次电话、视频和邮件讨论,我们终于坐在我伯克利的办公室里,为这次短暂但成果丰硕的合作而感到惊叹。
埃马纽埃尔和克日什托夫这次来,是为了参加第五届CRISPR研讨会。这次会议共有来自世界各地二三十位研究人员参加,大多数来自食品科学和微生物学领域,因为当时CRISPR还没有引起更大范围科学同人的关注。从2002年到2012年,这个领域里只有几百篇文献。不过,我们知道,情况很快会发生变化。这次会议可以说恰逢其时。一方面,我们可以跟其他同行交流工作进展;另一方面,过去的几周,工作进展如此迅速,我们的精神高度紧张,我们也需要放松一下。完成了GFP实验,我们决定让这个项目尽快收官,完成一篇研究论文。
在马丁和克日什托夫即将完成实验,异国他乡的合作者启程来伯克利之际,埃马纽埃尔和我就动笔了。我们的论文主要集中于阐释CRISPR在化脓链球菌里对抗病毒的防御机制,但是我们也想指出实验结果的深远影响。在论文的摘要部分,我们特地写了一句话,指出了这种可以切割DNA的酶对于基因编辑的用处。
此外,在文章的结论部分,我们也点明了CRISPR在其他细胞类型中的应用潜力。提及了锌指核酸酶和TALENs之后,我们总结道:“基于Cas9蛋白质和定制RNA,我们开发了一套新的方法,它在基因靶向定位和基因编辑上有极大潜力。”
2012年6月8日,一个明媚的周五,当天下午,我在电脑上正式向《科学》杂志提交了论文。20天后,它在线发表了。
世界从此而不同⸺不仅对我和合作者而言,也不仅仅对生物学领域而言。然而,在那一刻,我昂扬的情绪荡然无存,反倒感到从未有过的疲惫。我感觉自己好像在电脑前连续坐了好几个星期了,于是站起身来⸺略感到一丝晕眩,踱步走出斯坦利楼。伯克利的校园绿意盎然,楼前圆形水池外的草地上空空荡荡。一个月前,春季学期结束了,往日熙熙攘攘的校园,现在安静得似乎有点不寻常。当然,回头来看,这不过是暴风雨来临前的平静。
作者丨[美]詹尼佛·A.杜德娜 赛缪尔·H.斯坦伯格
摘编丨安也
编辑丨罗东
导语部分校对丨刘军











