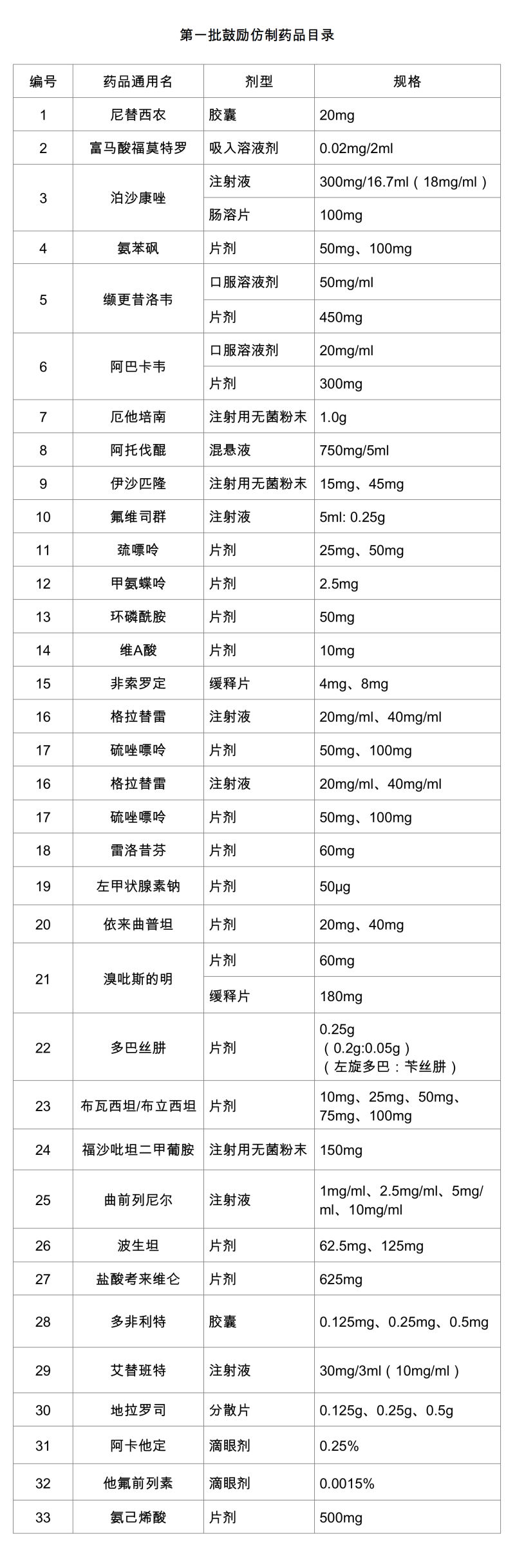
新京报讯(记者 王卡拉)10月9日,国家卫生健康委发布“第一批鼓励仿制药目录”,其中不乏一些紧缺药品,如甲氨蝶呤、巯嘌呤、维A酸等。
2018年4月,国务院办公厅印发的《关于改革完善仿制药供应保障及使用政策的意见》指出,要促进仿制药研发,重点解决高质量仿制药紧缺问题,提高药品供应保障能力,更好地满足临床用药及公共卫生安全需求,要制定鼓励仿制药品目录,引导企业研发、注册和生产。被列入“鼓励仿制药品目录”的重点化学药品、生物药品,其关键共性技术研究将列入国家相关科技计划,对其注册申请进行优先审评审批。
此次发布的“第一批鼓励仿制药目录”由国家卫生健康委联合科技部、工业和信息化部、国家药监局、国家知识产权局等部门,组织专家进行遴选论证。与今年6月国家卫生健康委曾公示的“首批鼓励仿制药品目录建议清单”相比,品种数量从34种减少到33种,抗艾滋病新药利匹韦林最终没有出现首批目录中。利匹韦林2018年10月才在中国内地上市,为新一代非核苷类反转录酶抑制剂。利匹韦林的剔除原因并未公布。
纳入目录的33个品种,都属于国内专利到期和专利即将到期、尚没有提出注册申请,或临床供应短缺(竞争不充分)以及企业主动申报的药品。这33个品种包括多种抗癌药、帕金森病药物、癫痫药物、降脂药物、儿童药物等。豪森药业、正大天晴参与了目录中四种药物的研发,另有海正药业、华威医药等参与3种药物研发。
以富马酸福莫特罗为例,新京报记者查询丁香园Insight数据库看到,目前已经有包括福安药业在内的4家企业提出上市申请,另有10余家企业处于补充申请、临床试验等阶段。
目录中也有国内尚未上市的品种(剂型),如泊沙康唑注射液,包括原研药企业默沙东在内,共有15家企业在申报。其中,默沙东、宣泰医药、奥赛康药业和圣诺生物四家企业提出上市申请,奥赛康的泊沙康唑注射液被列为优先审评品种。
编辑 岳清秀 制图 李禾炜 校对 刘军









