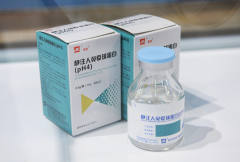
新京报讯(记者 王卡拉)7月27日下午,博晖创新发布公告,控股子公司河北大安制药有限公司(以下简称“河北大安”)研发的静注人免疫球蛋白(pH4)产品已收到国家药监局核准签发《药品注册证书》,这是国内首次根据《药品注册管理办法》进行完整临床研究和相关毒理研究的静注人免疫球蛋白产品。
河北大安研发的静注人免疫球蛋白(pH4)主要适用于原发性免疫球蛋白缺乏症,如X联锁低免疫球蛋白血症、常见变异性免疫缺陷病、免疫球蛋白G亚型缺陷病等;继发性免疫球蛋白缺陷病,如重症感染、新生儿败血症等;自身免疫性疾病,如原发性血小板减少性紫癜、川崎病等。
博晖创新介绍,本次获批的静注人免疫球蛋白(pH4)是国内首个采用国际通行的最先进的20nm级纳米膜过滤器去除病毒,对颗粒较大的脂包膜病毒和颗粒较小的非脂包膜病毒均具有良好地去除作用,能较好的确保产品病毒安全性。临床研究结果显示,其对相关适应症临床疗效较好;通过对产品的lgG亚类分析测定,制品中IgG亚类齐全,且比例与正常人血清的IgG亚类分布接近。
博晖创新表示,静注人免疫球蛋白属于血液制品的重要品种,上述注册证的取得,丰富了河北大安血液制品产品的种类,将提高河北大安血浆的利用效率,对河北大安未来业绩的提升具有重要的意义。鉴于血液制品的生产和销售特点,预计不会对河北大安及公司本年度业绩产生重大影响。
校对 柳宝庆